Существует множество предрасполагающих факторов: наследственность, близорукость любой степени, особенно с растяжением переднезадней оси глаза, черепно-мозговые травмы, травмы органа зрения, заболевания шейного отдела позвоночника, сколиоз, дети, родившиеся в результате тяжелого течения беременности и родов, недоношенные дети.
Как правило, изменения сетчатки на периферии протекают без жалоб, и обнаруживаются при подробном осмотре глазного дна врачом-офтальмологом на фоне максимально расширенного зрачка. В том, что такая опасная патология никак не проявляет себя и заключается ее «коварство»: в любой момент она может привести к отслойке сетчатки с выраженным снижением зрения, тяжелым лечением и сложным прогнозом по остроте зрения. У некоторых внимательных пациентов могут быть плавающие помутнения перед глазами, появление молний, вспышек перед глазами.
Дистрофии сетчатки у пациентов врачами принято делить на требующие наблюдения и консервативного лечения и, так называемые, «риск формы» дистрофий сетчатки, в большом проценте приводящих к тяжелым осложнениям, требующих оперативного лечения.
Целью лечения является стабилизация изменений на глазном дне и профилактика отслойки сетчатки. Для этого выполняют профилактическую лазерную коагуляцию сетчатки в области дистрофических изменений, или отграничение вокруг уже существующего разрыва. Операция проводится под местной анестезией, лазерное лечение пациент воспринимает как яркие вспышки света, в послеоперационном периоде возникает легкий дискомфорт, снижение зрения на период от1 до 3 минут.
Основной способ профилактики дистрофий сетчатки и отслойки сетчатки – это регулярное наблюдение у офтальмолога с осмотрами глазного дна пациентов групп риска, при выявлении «риск форм» дистрофий сетчатки обязательное проведение профилактической лазерной коагуляции.
Пациенты с выявленными дистрофиями, пациенты группы риска должны проходить обследование у офтальмолога 1-2 раза в год.
Узнать подробнее о лазеркоагуляции сетчатки.
Смотрите также: Что делать, если у ребенка покраснел и гноится глаз Реакция слизистой оболочки, выстилающей веки изнутри и глазное яблоко на любой внешний раздражитель называется конъюнктивит. Амблиопия у детей Амблиопия или “ленивый глаз” – стойкое одно- или двустороннее снижение зрения, не связанное с органическими заболеваниями зрительного анализатора и не поддающееся коррекции оптическими линзами. Вернуться к списку
Ученые МФТИ в сотрудничестве с исследователями Гарварда вырастили клетки сетчатки, которые способны врастать в глаза. Это первая в мире успешная попытка трансплантации ганглионарных клеток (нейроны сетчатки, которые разрушаются при глаукоме), полученных из стволовых клеток в лабораторных условиях. Далее выращенные клетки нужно будет трансплантировать в сетчатку. Ученые проверили технологию на мышах и удостоверились в успешном встраивании клеток и их выживании на протяжении года. В дальнейшем исследователи планируют создать специализированные банки клеток, которые позволят индивидуально подбирать терапию для каждого пациента.
Операция «Трансплантация»
Первую в мире успешную попытку выращивания и трансплантации ганглионарных клеток сетчатки из стволовых произвели ученые лаборатории геномной инженерии МФТИ в сотрудничестве с исследователями Гарвардской медицинской школы. Ганглионарные клетки ответственны за передачу зрительной информации, и именно они повреждаются при глаукоме. Ученым удалось не только вырастить нейроны (ганглионары считаются специализированными нейронами), но и трансплантировать их в глаза мышей, добившись правильного врастания искусственной ткани сетчатки. Как известно, без лечения развитие глаукомы может привести к необратимому повреждению части зрительного нерва и, как следствие, потери части визуального поля. Прогрессируя в течение долгого времени, эта болезнь может привести и к полной слепоте.
В поле зрения: ученые открыли ген наследственной слепоты Болезнь вызывает мутация, из-за которой перестает вырабатываться важный белок
Клетки сетчатки были выращены в специальных органоидах, ткань формировалась в пробирке, рассказал «Известиям» младший научный сотрудник лаборатории геномной инженерии МФТИ Евгений Кегелес. Потом эти клетки пересадили мышам, которые были распределены в несколько групп.
— Были мыши с моделью глаукомы, мыши с повышенным внутриглазным давлением и те, у которых были удалены собственные ганглионары, — отметил Евгений Кегелес. — Были также новорожденные мыши: мы проверяли гипотезу более успешной приживаемости молодых ганглионарных клеток в формирующейся сетчатке. В результате оказалось, что клетки встроились и прорастили аксоны, которые позволят связать глаз с мозгом. Улучшенная выживаемость клеток у новорожденных мышей дает нам перспективное направление для поиска наилучшего микроокружения.
По словам Евгения Кегелеса, эти клетки успешно просуществовали внутри сетчатки 12 месяцев, что является серьезным сроком для такого исследования. Ученым удалось убедиться, что они получают зрительные сигналы, однако то, что клетки передают сигналы в мозг, со стопроцентной уверенностью утверждать пока нельзя.
— Мы точно знаем, что выращенные клетки встраиваются куда надо, протягивают аксоны в мозг, но их функциональность оценить пока невозможно, — объяснил Евгений Кегелес. — Это связано с тем, что до сих пор нам не удалось вырастить большое количество клеток. Это вопрос ближайших лет.
По его словам, исследователям нужен год, чтобы они смогли оценить функциональность клеток на мышиных моделях. В течение этого времени можно будет получить доказательство, что клетки не просто правильно встроены в структуру глаза, а они именно «видят».
Клеточный банк
Сейчас мышиные клетки сетчатки удается вырастить примерно за 21 день. В случае человека это будет от 50 до 100 дней, говорят ученые МФТИ.
Однако, скорее всего, человеку с глаукомой, готовящемуся к трансплантации, не нужно будет выращивать ткань сетчатки из собственных стволовых клеток. Так как глаз является иммунопривилегированным органом, где отторжения редки, возможно создать банк клеток для таких пациентов. Там будут размещены или выращенные клетки сетчатки от универсального донора, или из индуцированных плюрипотентных стволовых клеток. Это значит, что можно будет заранее вырастить клетки, заморозить их и, когда пациент с глаукомой обратится за помощью, подобрать для него наилучший клеточный вариант для трансплантации.
Земля не плоская: вернуть объемное зрение помогут компьютерные очки Разработанный российскими учеными прибор исправит серьезную патологию за несколько месяцев в домашних условиях
Впоследствии эту технологию можно будет применять и для лечения других заболеваний глаз, например дистрофии сетчатки. Однако выращивать придется другие клетки.
— Нобелевскую премию за индуцированные плюрипотентные стволовые клетки дали почти 10 лет назад, в 2012 году, — отметил руководитель лаборатории геномной инженерии Павел Волчков. — Так называемый хайп, когда буквально все научные коллективы считали своим долгом заниматься этой тематикой, давно угас. Сейчас настало время не просто слов, а реальных технологий на основе iPS (искусственные плюрипотентные стволовые клетки человека. — «Известия»). И именно к таким технологиям относится исследование по трансплантации ганглионаров сетчатки. Это возможность показать, что стволовые клетки реально можно применить на практике, с их помощью можно что-то исправить. Хотя эта работа еще не доведена до клиники, но она уже в нескольких шагах от реальной пересадки с целью лечения глаукомы.
Учитывая большой опыт экспериментальных работ мировых ученых и активное изучение вопроса заместительной клеточной терапии в офтальмологии, в дальнейшем метод может привести к прорыву в диагностике и лечении глаукомы, считает заведующая отделением офтальмологии ФГБУ НМИЦО ФМБА России, действительный член Европейского общества катарактальных и рефракционных хирургов (ESCRS), член Российского общества офтальмологов Ника Тахчиди.
Слепой метод: что помогает незрячим ориентироваться в телефоне и мире Прототипов сотни, реально доступных устройств — единицы
— В ряде зарубежных работ показано, что введенные клетки встраиваются в сетчатку и частично дифференцируются в клетки сетчатки. В настоящее время описаны и обсуждаются два основных механизма действия клеток in vivo и in vitro. Замещающая терапия — когда клетки, образующиеся в результате дифференцировки введенных стволовых клеток, «включаются» в восстанавливаемую ткань. «Эффект стороннего наблюдателя» — когда вводимые стволовые клетки оказывают противовоспалительное, трофическое или иммуномодулирующее действие на восстанавливаемую ткань. Однако, несмотря на прорыв в изучении морфофунциональных свойств стволовых клеток, обеспечить гарантированное послойное замещение культивированными клетками поврежденных участков сетчатки при использовании практикуемых методов введения на сегодняшний день невозможно, что и подтверждается рядом экспериментальных работ, — сказала Ника Тахчиди.
Впрочем, многие ученые в мире сейчас работают в этом направлении, пытаясь создать клеточную терапию лечения атрофии зрительного нерва, дистрофии сетчатки и глаукомы, отметила заведующая отделением офтальмологии клинико-диагностического центра «Медси», врач-офтальмолог Ирина Евсегнеева.
— Но никаких данных на сегодняшний день о том, что пересаженные клетки передают изображение, нет. Любая идея, как это сделать, заслуживает внимания, — сказала она.
По оценке ученых МФТИ, на доведение технологии до применения в лечебной практике уйдет примерно 10 лет.
Читайте также Порядка 40 млн слепых людей во всем мире нуждаются в технологиях, которые могут вернуть способность видеть. Однако до сих пор не существует доступного способа протезирования зрения
Мы привыкли ассоциировать зрение лишь с глазами. Однако помимо самих глазных яблок в процессе участвует зрительная кора головного мозга, которой мы фактически «видим», и нервные пути, которые соединяют глаза с мозгом. Практически на каждом этапе можно попытаться реализовать протезирование.
История создания зрительного протеза
Немецкий психолог Иоганн Пуркинье в 1823 году заинтересовался вопросами зрения и галлюцинаций, а также возможностью искусственной стимуляции зрительных образов. Принято считать, что именно он впервые описал зрительные вспышки — фосфены, которые он получил при проведении простого опыта c аккумулятором, пропуская через голову электрический ток и описывая свой визуальный опыт.
Спустя 130 лет, в 1956 году, австралийский ученый Дж. И. Тассикер запатентовал первый ретинальный имплант, который не давал какого-то полезного зрения, но показал, что можно искусственно вызывать зрительные сигналы.
Ретинальный имплант (имплант сетчатки) «вводит» визуальную информацию в сетчатку, электрически стимулируя выжившие нейроны сетчатки. Пока вызванные зрительные восприятия имели довольно низкое разрешение, но достаточное для распознавания простых объектов.
Но глазное протезирование долго тормозилось из-за технологических ограничений. Прошло очень много времени, прежде чем появились какие-то реальные разработки, которые смогли дать «полезное зрение», то есть зрение, которым человек мог бы воспользоваться. В 2019 году в мире насчитывалось около 50 активных проектов, фокусирующихся на протезировании зрения.
Первые ретинальные импланты
Пару лет назад на рынке было доступно три ретинальных импланта, которые прошли клинические испытания и были сертифицированы государственными регулирующими органами: европейским CE Mark и американским FDA.
- Second Sight Medical Products, США
- Pixium Vision, Франция
- Retina Implant AG, Германия
Так выглядели первые ретинальные импланты
Бионические импланты — это целая система внешних и внутренних устройств.
IRIS II (Pixium Vision) и Argus II (Second Sight) имели внешние устройства (очки с видеокамерой и блок обработки видеосигнала). Слепой человек смотрит при помощи камеры, с нее картинка направляется в процессор, где изображение обрабатывается и распадается на 60 пикселей (для системы Argus II). Затем сигнал направляется через трансмиттер на электродную решетку, вживленную на сетчатке, и электрическим током стимулируются оставшиеся живые клетки.
В немецком импланте Alfa АMS (Retina Implant) нет внешних устройств, и человек видит своим собственным глазом. Имплант на 1600 электродов вживляется под сетчатку. Свет через глаз попадает на светочувствительные элементы и происходит стимуляция током. Питается имплант от подкожного магнитного коннектора.
Субретинальный имплантат Alpha AMS компании Retina Implant AG
Все три ретинальных импланта больше не производятся, так как появилось новое поколение кортикальных протезов (для стимуляции коры головного мозга, а не сетчатки глаза). Однако хотя проектов по фундаментальным разработкам по улучшению ретинальных имплантов еще много, ни один из них не прошел клинические испытания:
- Улучшенный имплант DRY AMD PRIMA компании Pixium с увеличением количества электродов для стимуляции большего количества клеток сетчатки проходит клинические испытания. Для участия в программе испытаний еще ищут пять кандидатов;
- Retina Implant AG закрыли производство;
- Second Sight проводят клинические испытания своего кортикального импланта, но в марте 2020 года компания уволила 80% сотрудников из эксплуатационно-производственного подразделения.
Тренды ретинальных имплантов: основные фундаментальные технологии
Ретинальные нанотрубки
Группа ученых из Китая (Shanghai Public Health Clinical Center) в 2018 году провела эксперимент на мышах, в ходе которого вместо не функционирующих фоторецепторов сетчатки предложила использовать нанотрубки. Преимущество этого проекта — маленький размер нанотрубок. Каждая из них может стимулировать только несколько клеток сетчатки.
Биопиксели
Группа ученых из Оксфорда стремится сделать протез максимально приближенным к естественной сетчатке. Биопиксели в проекте выполняют функцию, схожую с настоящими клетками. Они имеют оболочку из липидного слоя, в который встроены фоточувствительные белки. На них воздействуют кванты света и как в настоящих клетках изменяется электрический потенциал, возникает электрический сигнал.
Перовскитная искусственная сетчатка
Все предыдущие фундаментальные разработки направлены на стимулирование всех слоев живых клеток. При помощи технологии перовскитной искусственной сетчатки китайские ученые пытаются предоставить возможность не только получать световые ощущения, но и различать цвет за счет моделирования сигнала таким образом, чтобы он воспринимался мозгом как имеющий определенную цветность.
Фотогальваническая пленка Polyretina
В Polyretina используется маленькая пленка, покрытая слоем химического вещества, которое имеет свойство поглощать свет и конвертировать его в электрический сигнал. Пленка размещена на сферическом основании, чтобы можно было удобно разместить ее на глазном дне.
Фотогальванический имплант Polyretina
Субретинальное введение полупроводникового полимера
Итальянские ученые предлагают технологию введения полупроводникового полимерного раствора под сетчатку, при помощи которого свет фиксируется и трансформируется в электрические сигналы.
Российский опыт ретинального протезирования
В России в 2017 году при поддержке фондов «Со-единение» и «Искусство, Наука и Спорт» было приобретено и установлено два ретинальных импланта Argus II американской компании Second Sight. Это единственные операции по восстановлению зрения, которые были проведены в России за все время. Каждая операция вместе с реабилитацией стоила порядка 10 млн руб, а сама система имплантации для одного пациента — порядка $140 тыс. Все прошло успешно, и два полностью слепых жителя Челябинска — Григорий (не видел 20 лет) и Антонина (не видела 10 лет) — получили предметное зрение. Предметное зрение означает, что человек может видеть очертания предметов — дверь, окно, тарелку — без деталей. Читать и использовать смартфон они не могут. Оба пациента имели диагноз «пигментный ретинит» (куриная слепота).
На момент 2019 года в мире установлено около 350 имплантов, произведенных компанией Second Sight. Около 50 тысяч россиян нуждаются в подобном протезе сетчатки.
В России опытом в протезировании зрения может похвастаться лишь один проект — АНО Лаборатория «Сенсор-Тех».
«Трендом в фундаментальных разработках бионических протезов является стремление сделать их максимально безопасными, приближенными к биологическим тканям людей и с максимально возможным разрешением. Но настоящую революцию вызвали кортикальные импланты, и смысл в ретинальных имплантах пропал, так как они ставятся только при пигментном ретините и возрастной макулярной дегенерации при отсутствии ряда противопоказаний. Кортикальные же импланты значительно расширяют горизонт показаний и позволяют восстанавливать полезное зрение даже людям, вовсе лишенным глаз», — рассказал Андрей Демчинский, к.м.н., руководитель медицинских проектов АНО Лаборатория «Сенсор-Тех».
Кортикальные системы имплантации
Кортикальные протезы — это подгруппа визуальных нейропротезов, способных вызывать зрительные восприятия у слепых людей посредством прямой электрической стимуляции затылочной коры мозга, которая отвечает за распознавание изображений. Этот подход может быть единственным доступным лечением слепоты, вызванной глаукомой, терминальной стадией пигментного ретинита, атрофией зрительного нерва, травмой сетчатки, зрительных нервов и т.п. За последние пять лет ученые решили задачу создания такого внутрикортикального визуального нейропротеза, с помощью которого можно было бы восстановить ограниченное, но полезное зрение.
В 1968 году Г.С. Бридли и В.С. Левин провели первую операцию по установке кортикальных имплантов. Первый имплант состоял из шапочки с коннекторами (устанавливали на череп под кожу) и отдельной дуги с электродами (устанавливали под череп), которые стимулировали кору головного мозга. Эксперимент был проведен на двух добровольцах для оценки возможности получения полезного зрения. Позднее импланты были извлечены. Технология кортикальных имплантов была заморожена по причине провоцирования приступов эпилепсии при стимуляции большего количества клеток мозга.
Кортикальный имплант Orion
Спустя 45 лет американский лидер разработки ретинальных имплантов Second Sight создал кортикальную протезную систему ORION. В конце 2017 года Second Sight получили разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на проведение клинических испытаний. До апреля 2018 года было установлено шесть устройств. По результатам испытаний оказалось, что все пациенты ощущали зрительные стимулы, a у трех пациентов результаты были схожи с ретинальным имплантом Argus II и дали полезное предметное зрение. Клинические испытания будут проходить до июня 2023 года. Обязательным условием установки импланта является наличие у пациента зрительного опыта, то есть он может использоваться только для людей со сформированной зрительной корой, которые родились зрячими и потеряли зрение.
Кортикальный нейропротез CORTIVIS
Испанские ученые разработали кортикальный имплант под названием CORVITIS. Протез состоит из нескольких компонентов. Одна или две камеры обеспечивают получение изображения, которое затем обрабатывается биопроцессором, чтобы преобразовать визуальный образ в электрические сигналы. На втором этапе информация сводится в серию изображений и передается по радиочастотной связи на имплантированное устройство. Этот радиочастотный блок обеспечивает беспроводную передачу питания и данных во внутреннюю систему. Имплантированный электронный блок декодирует сигналы, определяет и контролирует форму напряжения и амплитуду формы волны, которая будет подаваться на соответствующие электроды. Клинические испытания на пяти пациентах завершатся в мае 2023 года.
Интракортикальный зрительный протез (WFMA)
Американские ученые разработали технологию многоканальной внутрикортикальной стимуляции с помощью беспроводных массивов металлических микроэлектродов и создали беспроводную плавающую микроэлектродную решетку (WFMA).
Система протеза состоит из группы миниатюрных беспроводных имплантируемых решеток-стимуляторов, которые могут передавать информацию об изображении, снятом на встроенную в очки видеокамеру, непосредственно в мозг человека. Каждая решетка получает питание и цифровые команды по беспроводной связи, так что никакие провода или разъемы не пересекают кожу головы. Посылая команды в WFMA, изображения с камеры передаются непосредственно в мозг, создавая грубое предметное визуальное восприятие изображения. Хотя восприятие не будет похоже на нормальное зрение, с его помощью человек может вести самостоятельную деятельность. Система ICVP получила одобрение FDA для проведения клинических испытаний.
Кортикальный протез NESTOR
Голландские ученые также разработали схожую технологию системы протезирования. Принцип функционирования протеза такой же, как в проектах выше. Камера отправляет сигнал на имплант, который состоит из тысяч электродов и смарт-чипа. С помощью процессора зрительное восприятие можно контролировать и регулировать.
«Хотя полное восстановление зрения пока кажется невозможным, кортикальные системы создают по-настоящему значимые визуальные восприятия, при помощи которых слепые люди могут распознавать, локализировать и брать предметы, а также ориентироваться в незнакомой среде. Результат — в существенном повышении уровня жизни слепых и слабовидящих. Такие вспомогательные устройства уже позволили тысячам глухих пациентов слышать звуки и приобретать языковые способности, и такая же надежда существует в области визуальной реабилитации», — обнадежил Андрей Демчинский.
Атрофия сетчатки является одной из самых распространенных причин, по которым пожилые люди теряют зрение. Причиной данного заболевания является возрастная дегенерация макулы или желтого пятна, расположенного в центре сетчатки, которое как раз и отвечает за центральное зрение, позволяя нам различать предметы, читать, водить автомобиль.
Обычно, у данной болезни есть только один симптом – снижение четкости зрения. Бывает так, что она приводит к серьезному ухудшению зрения и причиняет серьезный ущерб качеству жизни заболевшего. Пациенты могут видеть уменьшенную картинку или изображения разные по размеру в правом и левом глазах.
Нередко люди за 60 не обращают особого внимания на вышеописанные симптомы, считая их стандартным процессом старения зрительного органа. Благодаря регулярным проверкам зрения у высококвалифицированного специалиста-офтальмолога это заболевание можно диагностировать на ранней стадии.
Для диагностики атрофии сетчатки выполняются проверки глазного дна и делаются снимки после введения контрастного вещества. Не смотря на то, что данное заболевание почти никогда не становится причиной полной слепоты, оно является ограничением для выполнения больным ежедневных действий, потому важно его диагностировать еще на начальной стадии развития. Существует 2 типа атрофии сетчатки: “сухой” (легкая форма) и “влажный” (тяжелая форма, угрожающая качеству зрения).
= Способы лечения атрофии сетчатки = Хорошо, если распознать заболевание и начать лечение удается на ранней стадии. В наши дни есть несколько способов его лечения, позволяющих затормозить развитие болезни, а иногда и улучшить состояние больного. В простых случаях при “сухом” типе заболевания, в комплекс лечения входит прием специальных витаминов, снижающих риск ухудшения состояния здоровья до “влажного”.
Если раньше методов лечения атрофии сетчатки было совсем не много и они, в основном, были основаны на разных видах воздействия на сетчатку лазерного луча, то сегодня есть новые, более современные способы лечения, такие как фотодинамическая терапия (PDT). При “влажной” форме болезни помогают инъекции лусентиса или авастина в стекловидное тело. Данные вещества предотвращают развитие отека сетчатки и болезни кровеносных сосудов, являющейся причиной вышеописанного заболевания.
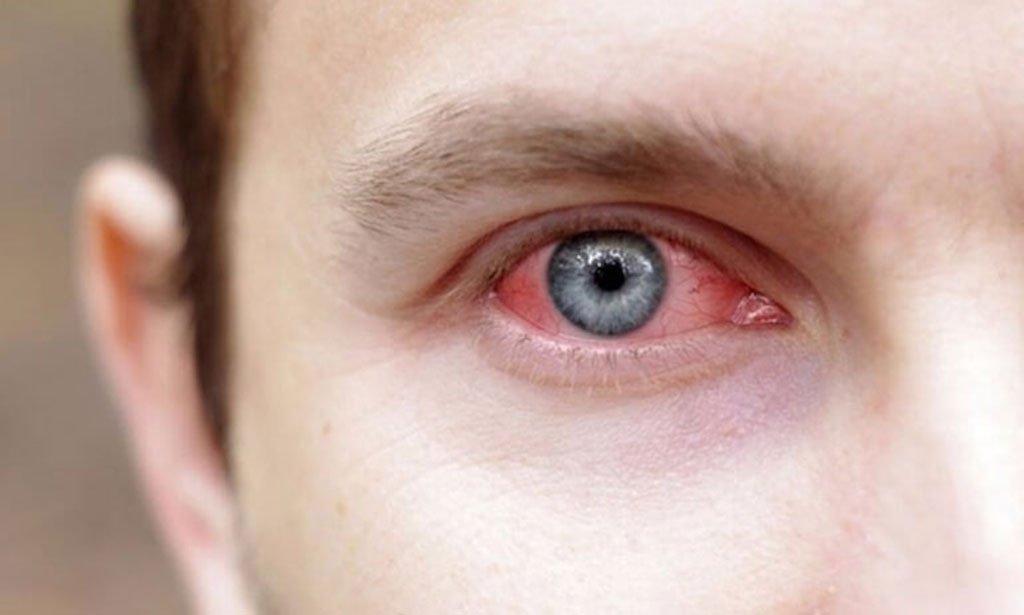
Воспалительные заболевания сетчатки без своевременного лечения становятся причиной ухудшения зрительной способности и слепоты. Возникают в результате инфицирования после оперативного лечения или травматизма, также развиваются при слабой иммунной системе и на фоне хронических патологий.
Глазная клиника «Мединвест» использует передовые методики для диагностики и лечения воспалительных болезней сетчатки.
Симптомы
- Снижение остроты зрения;
- Возникновение плавающих пятен, фотовспышек, молний, мерцающих огней;
- Проявление «тумана» перед глазами;
- Выпадение участков из поля зрения;
- Покраснения сетчатки;
- Деформация, искажение линий и предметов.
При обнаружении этих симптомов запишитесь на прием и консультацию врача офтальмолога в нашу клинику. Проведем диагностику и назначим эффективную терапию.
Особенности болезни
Токсоплазмозный хориоретинит
Токсоплазмы – паразиты протозойного типа. Заражение происходит в результате потребления не проваренного, не прожаренного или сырого мяса КРС, в котором содержатся тканевые формы токсоплазмы. При стойкой иммунной системе, человек становится носителем.
Проявления токсоплазмозного хориоретинита:
- Катаракта;
- Атрофия зрительного нерва;
- Микрофтальм.
Патология проявляется в виде мультифокального или очагового хориоретинита, поражающего центральную область глазного дна.
Для лечения болезни пациенту назначается противотоксоплазмоз (клиндамицин, пириметацин), глюкокортикостероиды. После купирования острой формы, врачи задействуют лазерную фотокоагуляцию.
Туберкулезный хориоретинит
В этом случае воспалительное поражение глаз осуществляется вторично, возникает в результате очага туберкулезной инфекции в легких. Врачи для диагностики патологии применяют офтальмоскопию – процедура, определяющая диссеминированные туберкулы, которые склонны к рубцеванию.
У болезни отсутствуют особенности, при этом пациенты жалуются на следующие симптомы:
- Снижение остроты зрения;
- Изменение размеров и формы предметов;
- Возникновение пелены перед глазами.
Для лечения туберкулезного хориоретинита используется комплексная терапия, проводимая совместно с фтизиатром. За основу курса берутся противотуберкулезные препараты (рифампицин, изониазид), параллельно проводится стимуляция иммунной системы и противовоспалительная терапия.
Лечение
Лечение воспалительных заболеваний сетчатки выполняется комплексно. В зависимости от патологии пациенту назначаются:
- Противовирусные и антибактериальные препараты, уничтожающие возбудителей инфекции;
- Микрохирургическое вмешательство применяется при развитии осложнений;
- Иммунотерапия;
- Физиотерапия (цветолечение, магнитостимуляция);
- Озонотерапия и прочие методики.
Офтальмологи глазной клиники «Мединвест» используют передовые методики диагностики, распознающие заболевание на ранних стадиях. Устраним причины и болезненные проявления.